中国科学院生物物理研究所许瑞明团队在Genes & Development上,在线发表了题为Distinct histone H3-H4 binding modes of sNASP reveal the basis for cooperation and competition of histone chaperones的研究论文。该研究揭示了组蛋白伴侣sNASP-ASF1结合组蛋白H3-H4的协同与竞争机制,为阐释组蛋白H3-H4的结合模式及其在组蛋白伴侣网络间的传递提供了新视角。
组蛋白伴侣作为调控染色质组装的重要因子,与真核细胞表观遗传信息的提取与传递紧密相关,其功能异常会影响染色质正确组装,进而影响DNA复制与基因转录、基因组稳定和细胞重编程等生物学过程。此前,科研团队解析了组蛋白伴侣HJURP特异性识别着丝粒区组蛋白变体CENP-A的结构机理(Genes & Development,2011);揭示了组蛋白变体H3.3被其伴侣蛋白DAXX精确识别的结构基础(NSMB,2012),阐明了Asf1调控组蛋白乙酰化修饰的分子机制(Cell,2018)。然而,关于另一类伴侣蛋白sNASP如何在细胞中结合和存储组蛋白H3-H4以及组蛋白H3-H4如何在伴侣网络中接力传递,其分子机制尚不清楚。这一成果是在该研究方向的重要进展。
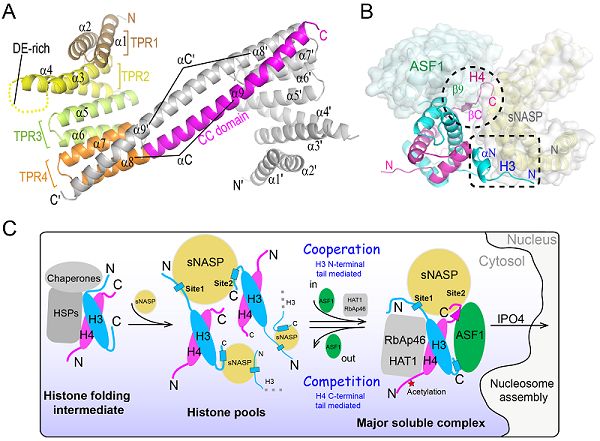
该研究发现了人源组蛋白伴侣sNASP在体外同时存在单体和二聚体两种形式,并解析了sNASP TPR结构域二聚体2.9?的晶体结构。该结构显示sNASP的TPR4 motif中的α8和Coiled-Coil domain(α9)形成一个超长螺旋αC,介导了sNASP二聚体的形成(图A)。αC不参与结合组蛋白H3-H4,但缺少该段结构域,将严重影响核小体的组装。研究团队解析了sNASP-ASF1-H3-H4四元复合物3.0?的晶体结构,复合物结构显示sNASP以单体形式存在于复合物中,介导sNASP二聚体形成的超长螺旋αC不再与邻近分子配对,而是一分为二(α8和α9),并以180度大转弯折回与自身配对;ASF1通过底物组蛋白H3-H4作为媒介,与sNASP间接作用;sNASP与组蛋白H3-H4之间的相互作用位点主要有两处——H3的N端尾巴中的αN和H4的C端尾巴(图B)。结合体外生化实验和体内细胞荧光共定位技术发现,在ASF1存在的情况下,H3的N端尾巴对于sNASP的结合至关重要。H4的C端尾巴对sNASP的相互作用只起到辅助作用,但当缺少H4的C端尾巴时,ASF1将被踢出去,形成sNASP-H3-H4三元复合物。这提示H4的C端尾巴可以介导组蛋白H3-H4在sNASP-ASF1之间的传递。此外,研究还发现,在没有ASF1的情况下,sNASP以全新的方式结合组蛋白H3-H4。此时的组蛋白H3-H4主要通过其核心区域与sNASP的TPR4 motif以及位于TPR2 motif中间的酸性loop区域存在相互作用。根据论文实验结果并结合先前研究,科研人员提出了组蛋白H3-H4在伴侣网络中接力传递的模式图(图C)。该图全面展示了细胞质中新合成的组蛋白H3-H4通过一系列伴侣蛋白的接力传递,最终进入细胞核进行染色质组装的途径。
医荟园,高端医学SCI科研服务平台
医荟园是中国领先的专业科研与英语母语学术编辑服务供应商,主要为非英语国家科研工作者提供最优质SCI﹑留学文书编辑和各类科研相关服务。目前,医荟园主要提供专业的SCI母语翻译,临床医学翻译,
医学论文翻译,医药认证翻译,医疗器械临床试验,海外医疗培训,医学SCI培训等。我们深知每一篇学术论文对于每个客户而言,都具有十分重要的价值。因此,我们将“专注专业,服务领先,客户至上”作为服务的核心价值观,以满足客户需求为前提,为客户提供高质量服务。
医荟园致力于搭建中国与世界科研互动的桥梁,为中国科研与学术研究贡献自己应有力量。同时,医荟园也将秉承科学、严谨的工作精神,凭借卓越的团队学术优势为客户提供一流的科研学术服务。医荟园汇聚了来自全球著名100多所顶尖高等教育学府的600多名各专业博士团队的雄厚学术力量。我们的愿景是为中国学术科研做出贡献,创造美好幸福生活;我们的使命是聚焦于客户需求,提供有竞争力的解决方案与服务,持续为中国学术做出贡献;我们的目标是成为国内最专业学术信息综合服务供应商。
声明:本网所有文章(包括图片和音视频资料)系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(yhysci@yhysci.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
 手机版
手机版

 小程序
小程序

 官方微信
官方微信

 在线咨询
在线咨询
 返回顶部
返回顶部