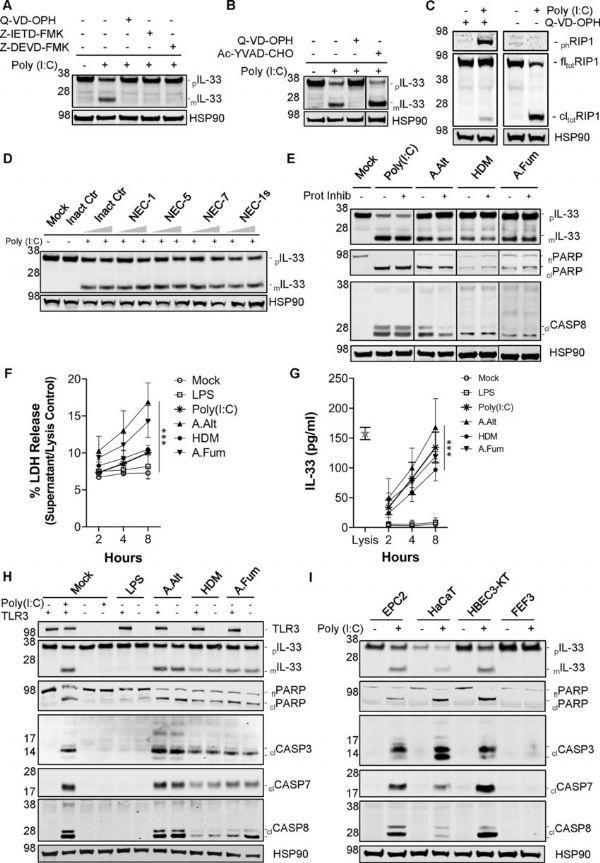
包括真菌、昆虫和螨虫在内的环境过敏原或会诱发机体2型免疫力,然而,研究人员并不清楚其发生背后的先天性感知机制以及初始信号事件。当机体接触到过敏原时,诱发机体炎性反应的内置快速反应系统就会帮助更多人群更好地管理其过敏症状。近日,一篇发表在国际杂志Nature Immunology上题为“Environmental allergens trigger type 2 inflammation through ripoptosome activation”的研究报告中,来自辛辛那提儿童医院医疗中心等机构的科学家们通过研究揭示了机体2型先天性免疫反应系统发挥作用的分子机制,通过识别一种常见的生物学反应平台,本文研究就表明,任何能够控制反应的新型药物或许就能让遭受多种过敏症的患者获益。
研究者Marc Rothenberg医学博士指出,干扰过敏原感知通路或许就能为对抗2型免疫力并减缓过敏性炎症提供一种独特的机会。此前研究结果表明,多种过敏原能在突破粘膜上皮层时诱导类似的IL-33反应,本文中,研究人员确定了这一过程中的工作机制。这一突破性研究或能帮助阐明ripoptosome信号和caspases在过敏性炎症发生过程中所扮演的关键角色。
具体来讲,过敏原会诱发一套相互关联的细胞死亡诱导信号—ripoptosome信号的活性,这种信号平台包括多种组分,但对于过敏性反应而言,关键的参与者似乎是一种称之为caspase 8的分子开关,研究者将这种通路命名为RipIL-33,因为IL-33能被ripoptosome所处理。在过去20年里,免疫学家通过研究已经发现了先天性免疫系统感知细菌和病毒的机制,但过敏原是如何被感知的,仍然是一个谜。
这一令人惊讶的机制的发现是本文研究的一项重大突破,有助于研究人员理解先天性免疫系统是如何感知过敏原从而启动2型免疫反应以及随后的过敏性炎症等。在小鼠机体中,抑制caspase 8的活性就能减少IL-33对过敏原暴露于的反应,并会限制肺部中的支气管炎症;而进一步研究分析结果表明,类似的过程或许也发生在人类机体中。
本文研究结果表明,在人类过敏性疾病嗜酸细胞性食管炎(Eosinophilic esophagitis,EOE)中,研究者发现,ripoptosome激活标志物和成熟的IL-33水平与EOE的程度和疾病的活动状态之间存在动态的关联。综上,本文研究结果揭示了一种上皮屏障、过敏原感知机制,其能集中于作为胞内分子信号平台的ripoptosome,从而就会诱发2型先天性免疫反应,而且这些研究发现还会对理解记治疗人类过敏性疾病具有重大意义。
声明:本网所有文章(包括图片和音视频资料)系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(yhysci@yhysci.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
 手机版
手机版

 小程序
小程序

 官方微信
官方微信

 在线咨询
在线咨询
 返回顶部
返回顶部